2
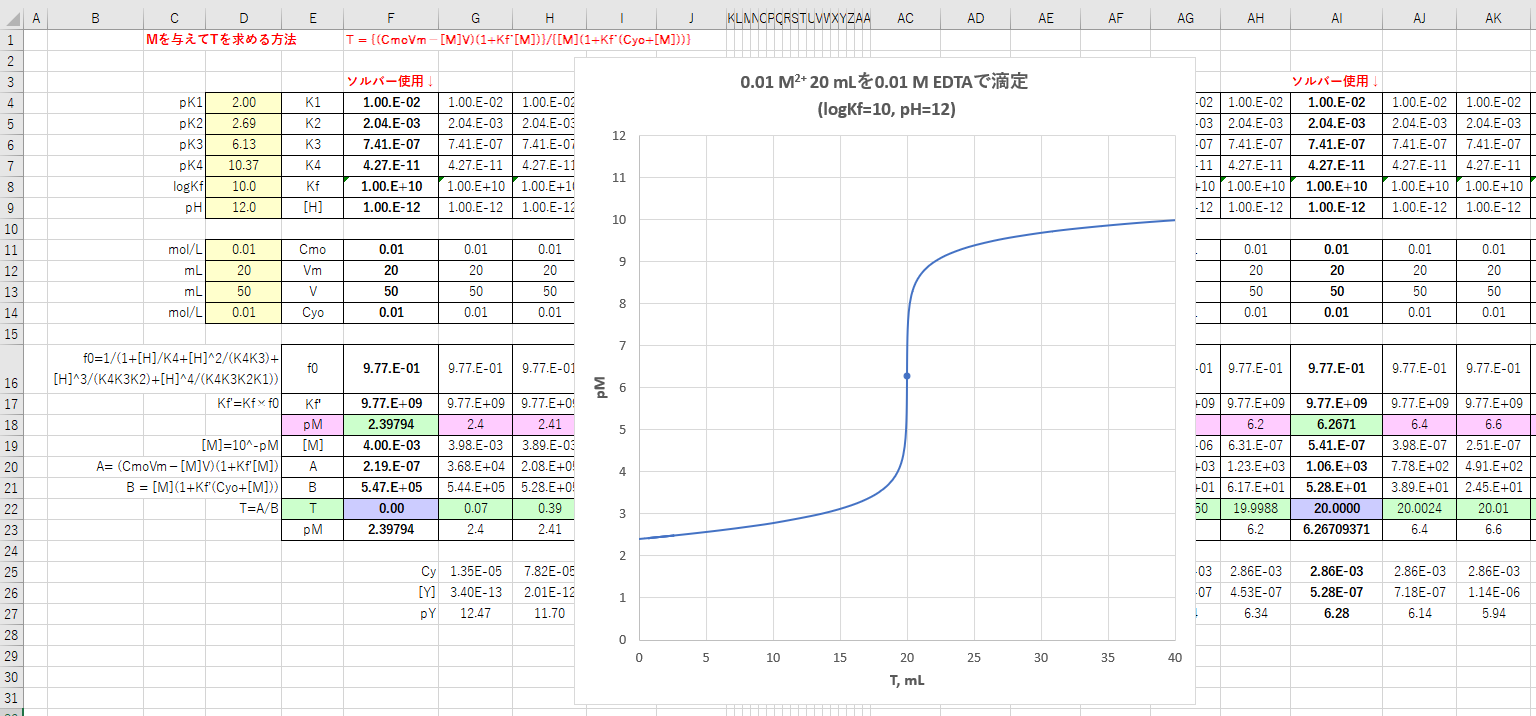
装 置 構 成; キレート滴定の濃度計算問題についてです。 解き方がわからないので、教えていただきたいです。 以下、問題内容です。 Ca2とMg2の混合溶液(以下Aとする) mLをとり,アンモニア−塩化アンモニウム緩衝液でpHを10とし,エリオクロムブラックT(EBT)を指示薬として加え, mol/L ED
キレート滴定 計算方法
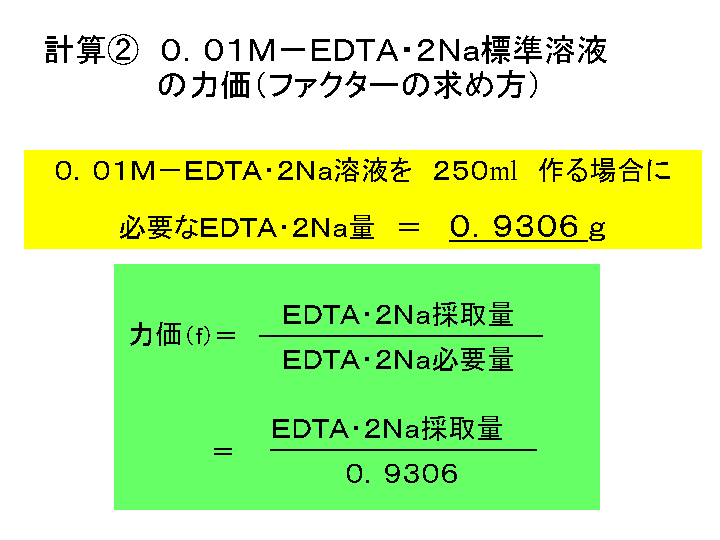
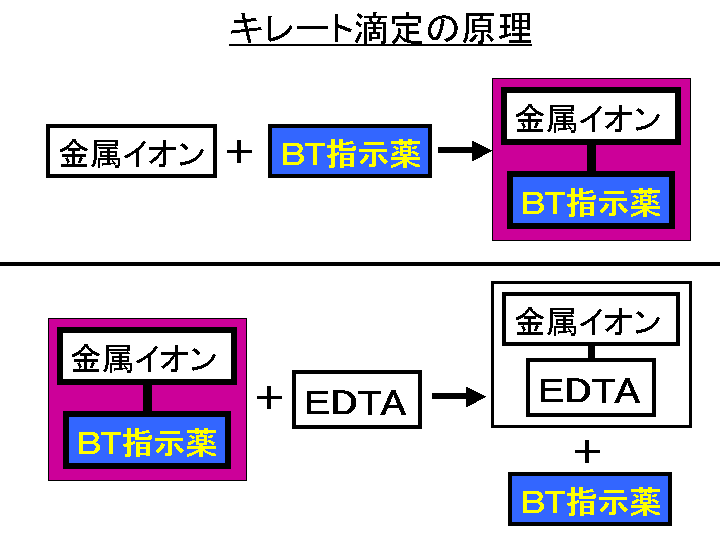
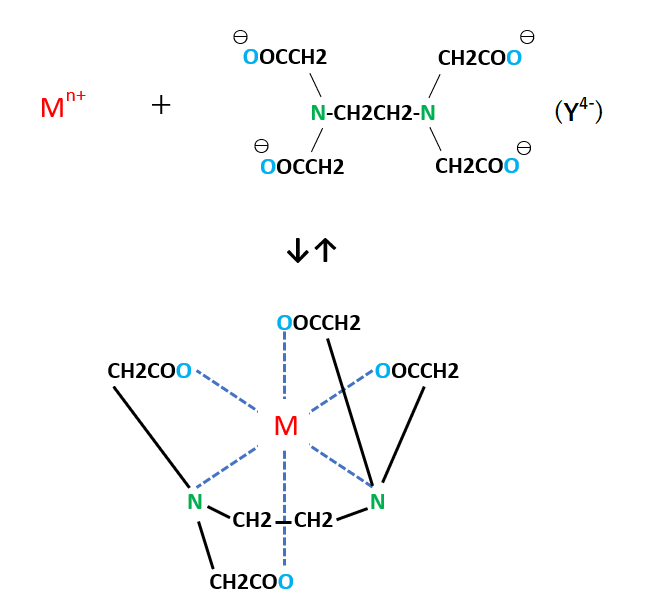
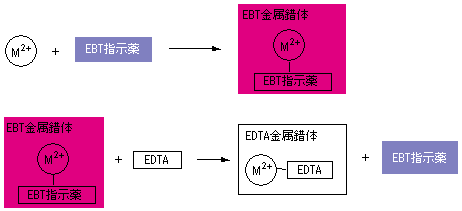
キレート滴定 計算方法-(キレートとはカニのはさみの意味)この反応を利用した金属イオンの定量治をキレート滴定 法法法法という。EDTAは水にほとんど溶けないので、キレート滴定では水に溶けやすいEDTA ・2Naを用いる。 全硬度の測定は、試料水のpHを約10 に調整した後,BT指示薬を加えて、EDTA溶洷 で滴定して キレート滴定の計算についてです。 ミネラルウォーターを001M EDTA標準溶液で滴定しました。 実験の結果から、カルシウムイオンとマグネシウムイオンの濃度の総和を求めよ。とのことなのですが、全くわかりません。 解法を教えてください。 また
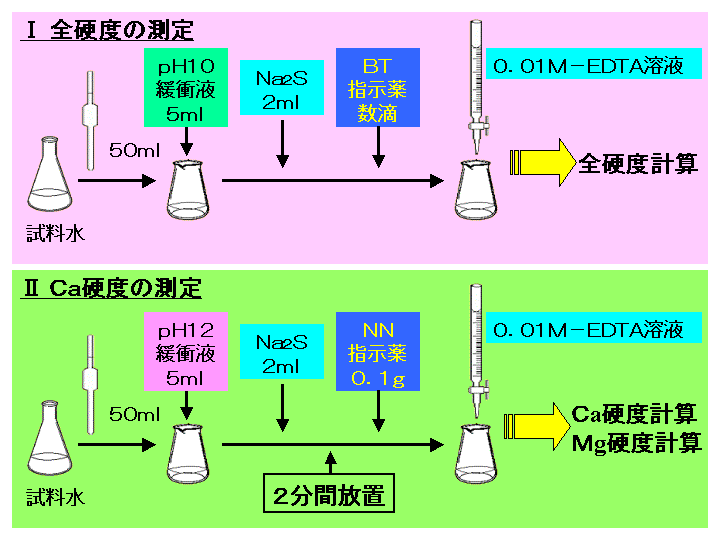
水の硬度測定 キレート滴定
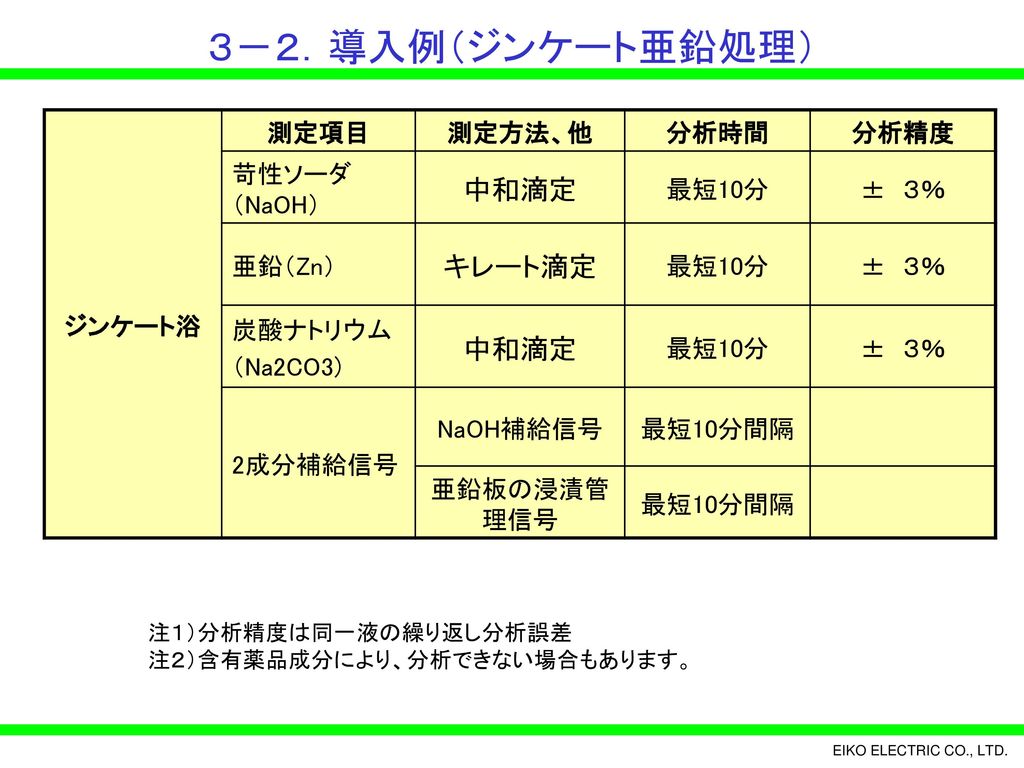
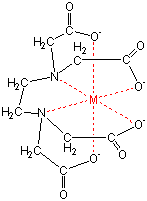
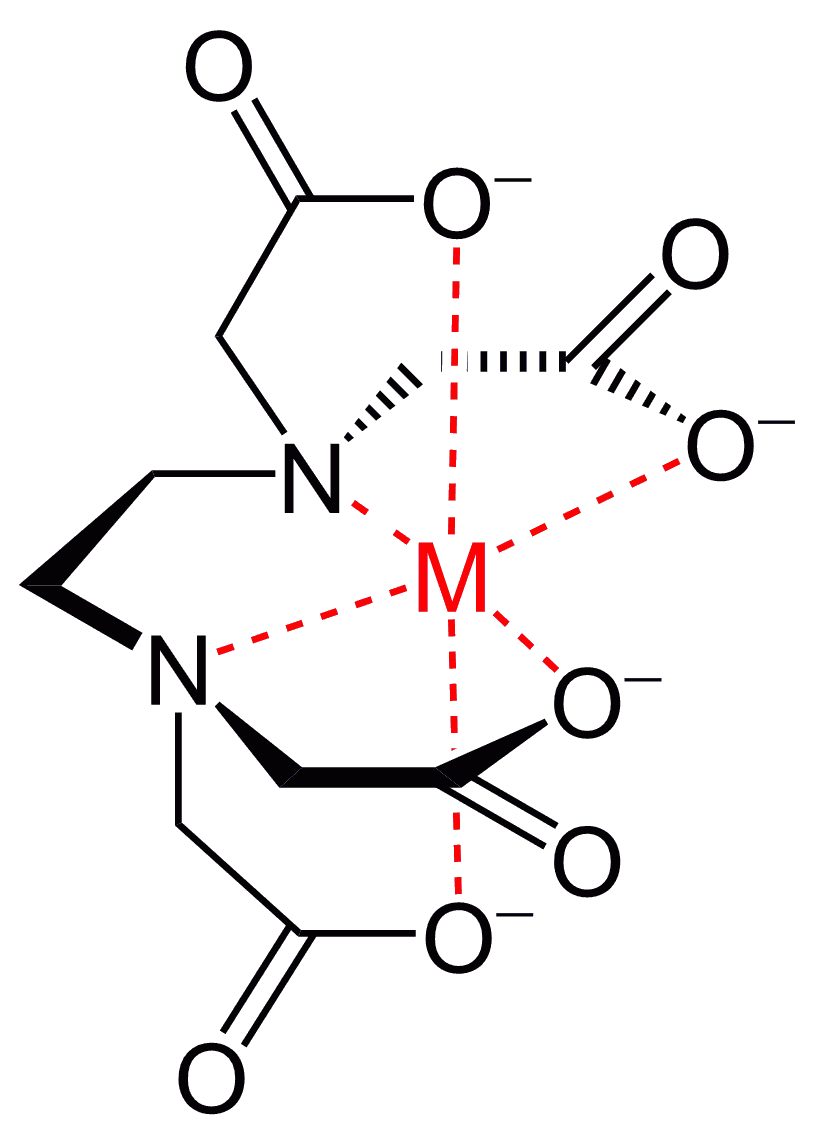
分析方法を開発することはとても重要である。真鍮は、銅と亜鉛の合金で、ほとんど の学生が知っている。 二ナトリウム塩 (na 2 h 2 edta ) 溶液を用いた キレート滴定 により分析する。これらの金 属は edta との錯体の安定度定数が近いので、 cu 2 イオンはマスキング剤(チオ硫酸 塩)によっEdta滴定によるアルミニウムの定量について1 マンガンの共存における アルミニウムの逆滴定法 一土壌分析への応用一 新名謹之助的 1序言 土壌・土壌粘土または土壌抽出液中のアルミニウムの直接的*定量法としては,筆者はすでに前報5)6) 」こおいて,隠蔽または溶媒抽出により鉄・チタン等使 用 試 薬 滴定液 0.01mol/L-EDTA溶液 (試験研究用) 試薬 28W/V%-水酸化ナトリウム溶液・・・水酸
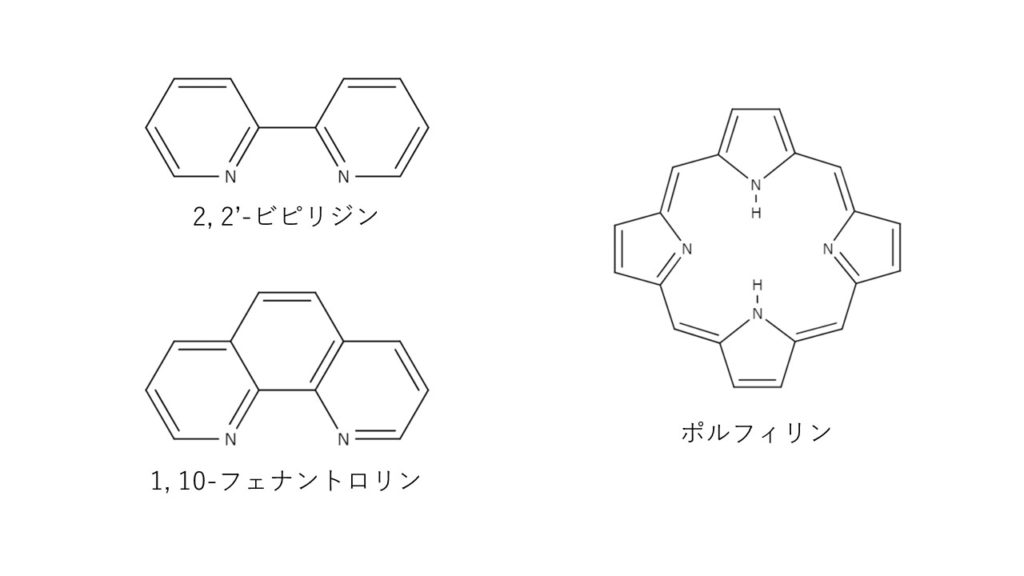
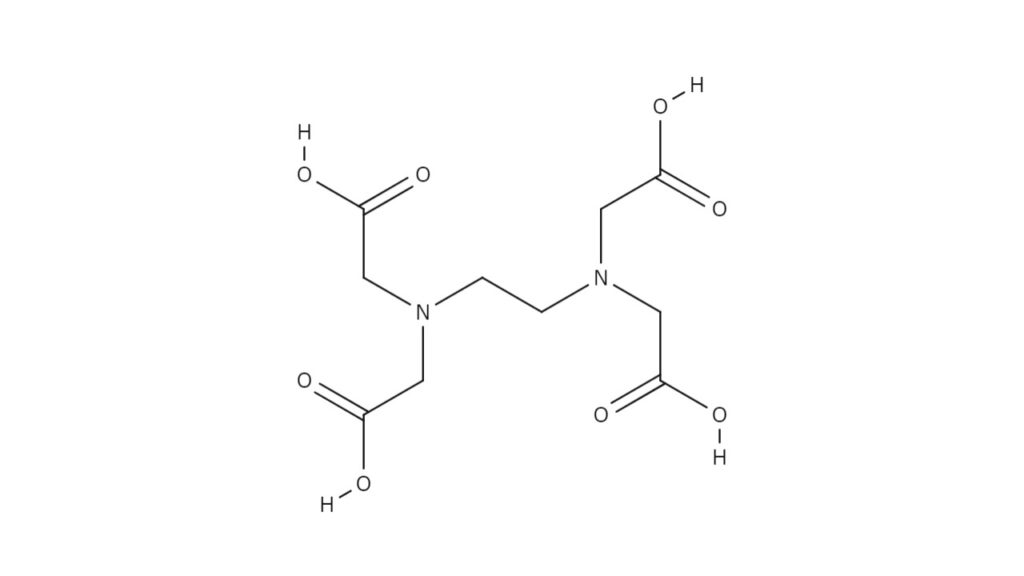
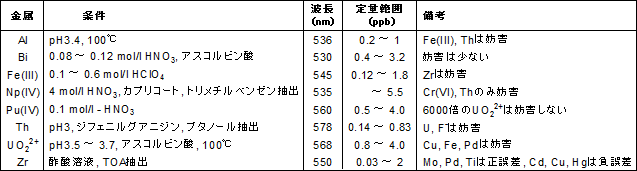
検出感度 500 計算式 005 mL 過滴加 mL 1 mL (DB)*K*F*M/S (2)その他の滴定方法について 亜鉛イオンのキレート滴定には、各種の指示薬およびpH 領域での滴定方法があります。 ① 指示薬 本項で用いたXO 指示薬(酸性でも使用可能)の他にアルカリ性側でよく使用される指示薬と してBT 指示自分でファクターを計算する方法 ファクターは自分で計算することもできます。 自分でファクターを計算する場合は 中和滴定を使います。 たとえばここに濃度が約01NのKOH (水酸化カリウム)の溶液があったとします。 この約01NのKOH溶液の正確な濃度が1.目的 2.原理 3.操作方法 4.結果 5.濃度計算 6.課題(x線構\造回析法、edtaキレートはどのような構\造の化合物か?
キレート滴定 計算方法のギャラリー
各画像をクリックすると、ダウンロードまたは拡大表示できます
 | ||
 |  | |
 |  | |
「キレート滴定 計算方法」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  | |
 |  | |
「キレート滴定 計算方法」の画像ギャラリー、詳細は各画像をクリックしてください。
 | ||
 |  | |
 |  | |
「キレート滴定 計算方法」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  |  |
 |  | |
「キレート滴定 計算方法」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  | |
 |  |  |
「キレート滴定 計算方法」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  |  |
「キレート滴定 計算方法」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  | |
 | ||
「キレート滴定 計算方法」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  | |
 |  | |
「キレート滴定 計算方法」の画像ギャラリー、詳細は各画像をクリックしてください。
 | ||
 |  | |
 |  |  |
「キレート滴定 計算方法」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  |  |
 | ||
「キレート滴定 計算方法」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 | ||
 |  | |
「キレート滴定 計算方法」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |
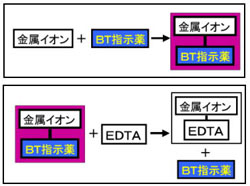
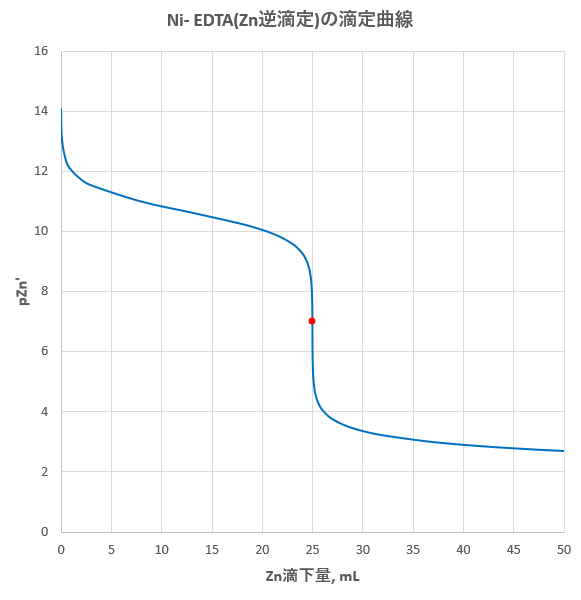
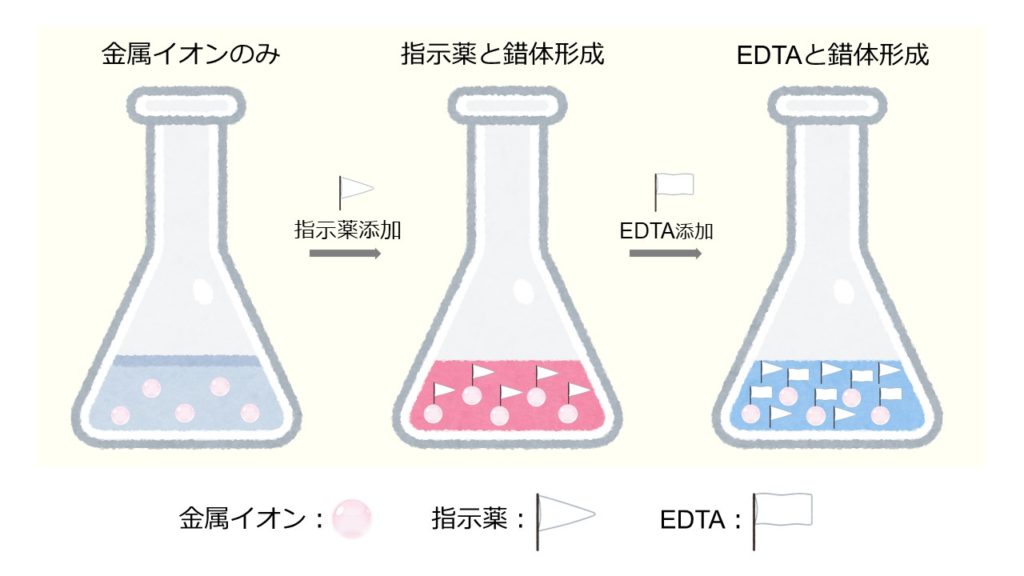
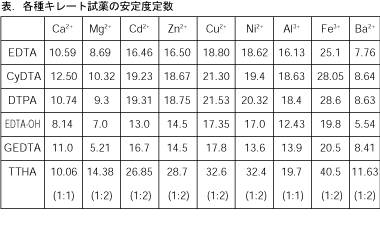
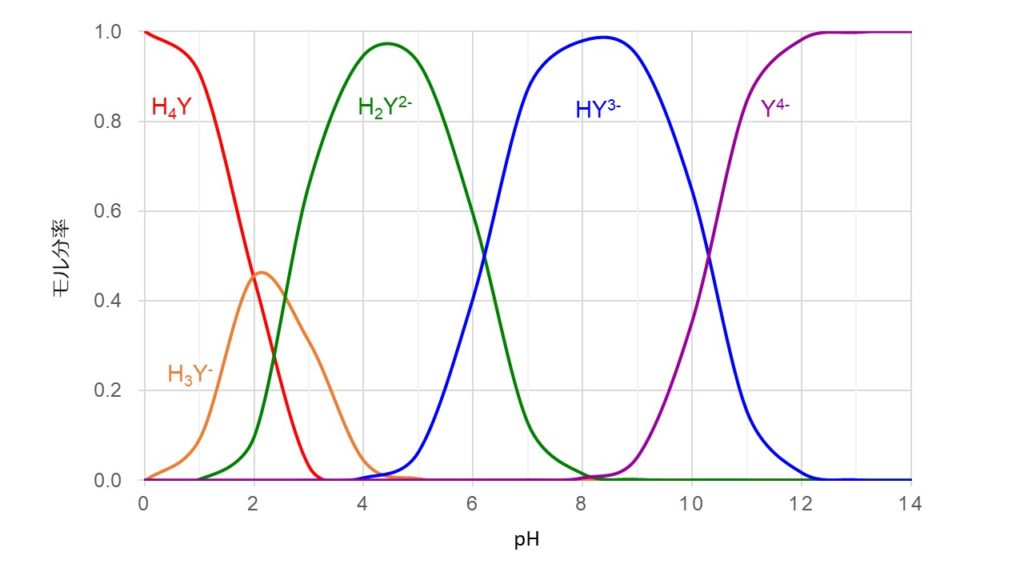
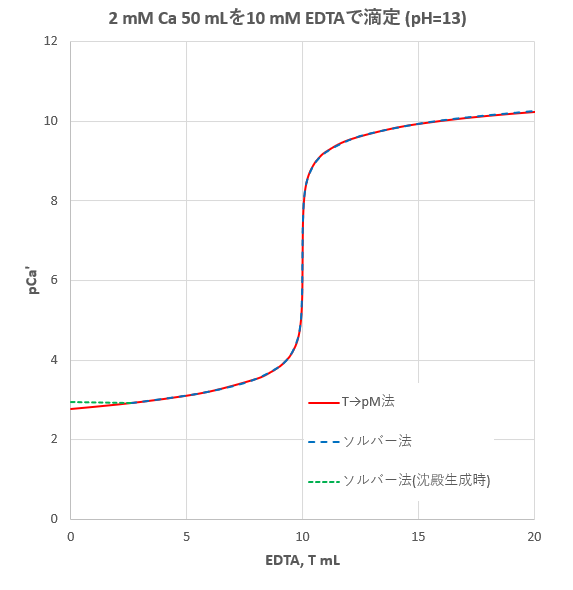
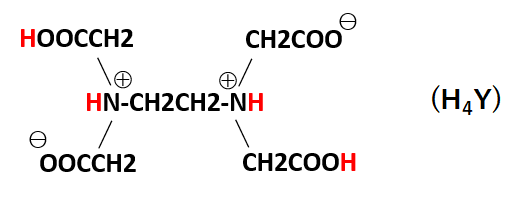
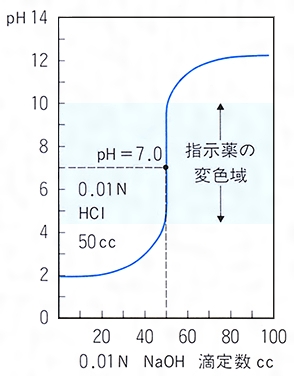
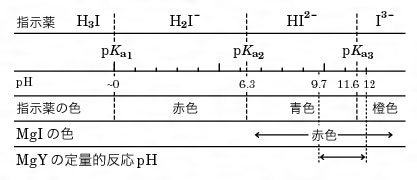
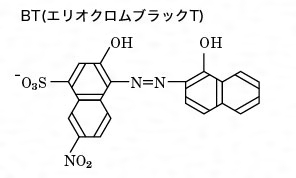
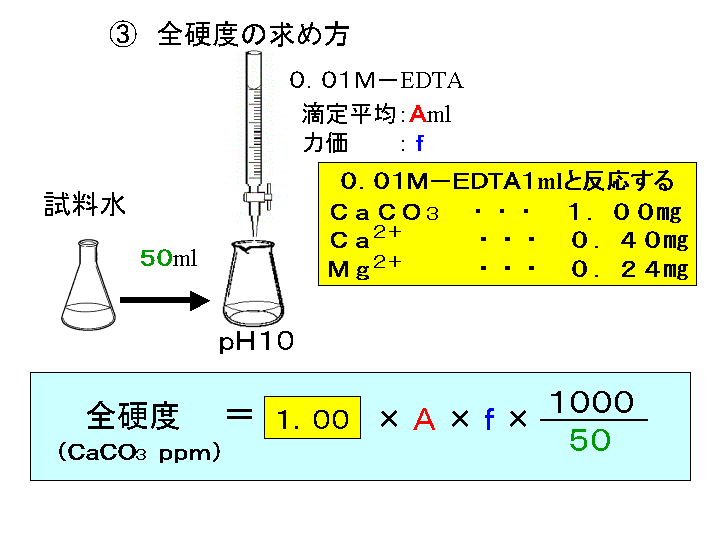
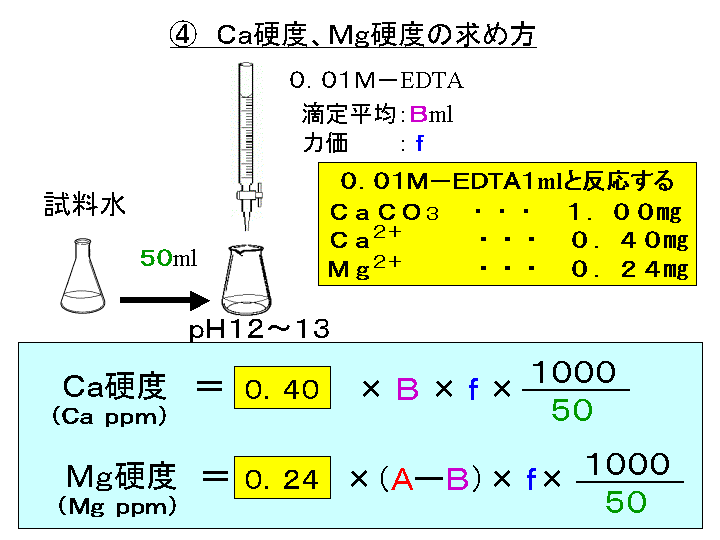
キレート滴定の原理図拡大 pH12~13において、Mg 2+ は安定な水酸化物となってEDTAと反応しなくなるので、このpH領域で作用するNN指示薬を用いて Ca 2+ のみを定量することができる。 試料水中に含まれる、Fe 2+ 、Cu 2+ などもEDTAと反応するが、隠ぺい剤としてNa2Sを加えておくと、鉛イオン(Pb2)の定量法としては、一般にキレート滴定が広く活用されています。鉛イオンを直 接滴定できるpH 領域はpH35~10(安定度定数=17)となっています。しかしアルカリ性領 域で
Incoming Term: キレート滴定 計算方法,




0 件のコメント:
コメントを投稿